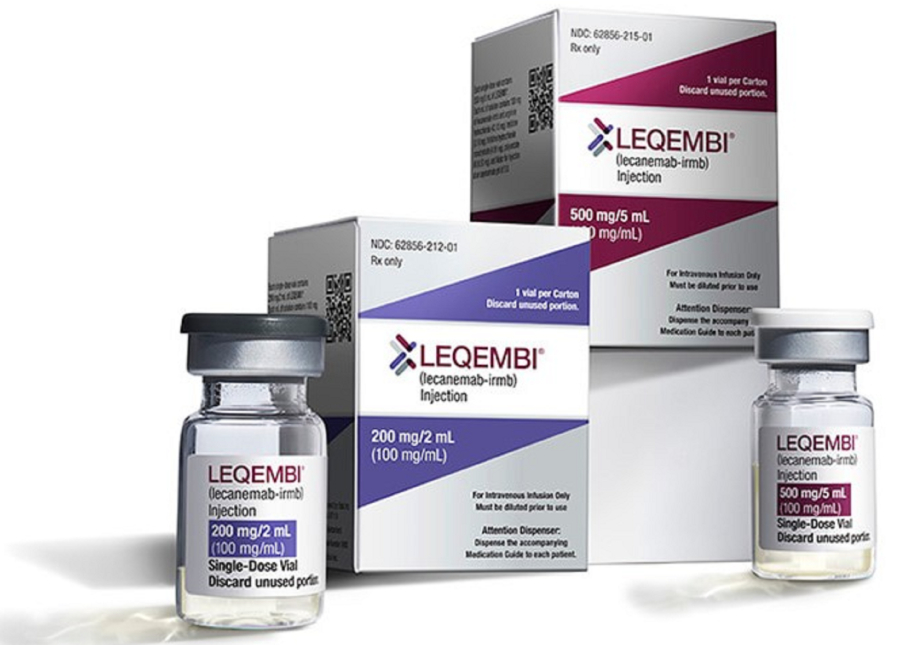
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) πρότεινε την έγκριση του Leqembi των Eisai και Biogen για κάποιους ασθενείς που είναι σε πρώιμο στάδιο Αλτσχάιμερ. Ένα σκεύασμα το οποίο είχε απορρίψει πριν από τέσσερις μήνες.
Αν αυτή η σύσταση γίνει δεκτή από την Κομισιόν, θα αποτελέσει την πρώτη θεραπεία στην ΕΕ για τη συγκεκριμένη νόσο, σύμφωνα με το Reuters.
Η Επιτροπή για φάρμακα ανθρώπινης χρήσης του EMA πρότεινε την έγκριση για μικρότερο σύνολο ασθενών από εκείνους που αξιολογήθηκαν στη δοκιμή του σκευάσματος. Συγκεκριμένα, πρότεινε την έγκριση του φαρμάκου για ασθενείς που έχουν ένα ή κανένα αντίγραφο παραλλαγής του γονιδίου ApoE4. Οι δοκιμές των Eisai και Biogen περιελάμβαναν και ασθενείς με δύο αντίγραφα της παραλλαγής του γονιδίου.
Τον περασμένο Ιούλιο ο EMA απέρριψε το συγκεκριμένο φάρμακο, επισημαίνοντας ότι η μικρή επίδραση του Leqembi στην επιβράδυνση της γνωστικής έκπτωσης δεν αντισταθμίζει τον κίνδυνο για σοβαρό οίδημα στον εγκέφαλο.
Τώρα, ο ΕΜΑ ανακοίνωσε ότι έπειτα από επανεξέταση κατέληξε πως τα οφέλη από το Leqembi στην επιβράδυνση της εξέλιξης των συμπτωμάτων του Αλτσχάιμερ είναι μεγαλύτερα από τους κινδύνους για ασθενείς με ένα ή κανένα αντίγραφο της παραλλαγής του γονιδίου ApoE4.
Οι ασθενείς με ένα ή κανένα αντίγραφο είναι λιγότερο να εμφανίσουν σοβαρές παρενέργειες όπως το οίδημα στον εγκέφαλο και πιθανή αιμορραγία που καταγράφηκε στις δοκιμές, σύμφωνα με τον ΕΜΑ.
Για την επαναξιολόγηση οι δύο φαρμακευτικές κατέθεσαν μια ανάλυση 1.521 ασθενών, που έχουν ένα ή κανένα αντίγραφο του ApoE4, από τους συνολικά 1.795 που συμμετείχαν στην έρευνα.
Στις ΗΠΑ, το Leqembi έχει εγκριθεί και για ασθενείς που έχουν δύο αντίγραφα του γονιδίου.